
ESSAIS BIOMÉDICAUX
Instron® apporte une richesse de connaissances à l’industrie biomédicale, agissant comme un partenaire stratégique pour les entreprises de toutes tailles. Nos équipements et services sont conçus pour vous aider à étudier les nouvelles technologies et à garantir la qualité des produits, tout en maintenant les plus hauts niveaux d’intégrité et de sécurité des données. Instron est ancrée dans l’industrie biomédicale depuis plus de 75 ans, et les défis technologiques, réglementaires et de fabrication auxquels sont confrontés nos clients nous ont incités à développer des produits et des services pour répondre à leurs besoins. Ces développements comprennent des montages spécialisés, des logiciels conformes et des capacités d’automatisation. Notre atout le plus précieux est notre vaste réseau de clients, qui représente un large éventail de fabricants de dispositifs médicaux et de produits pharmaceutiques, d’organisations de développement et de fabrication sous contrat (CDMO), d’universités, de centres d’essai et de jeunes entreprises.
Nos clients sont à l’avant-garde de l’innovation technologique médicale, travaillant à améliorer les résultats pour les patients en développant des produits nouveaux et améliorés. Ces entreprises améliorent l’efficacité des traitements mini-invasifs, développent la prochaine génération de capteurs portables et réinventent un avenir où les robots chirurgicaux sont monnaie courante dans les salles d’opération. Dans chaque cas, Instron a contribué à mettre en place un programme d’essais mécaniques robuste, capable de répondre aux exigences et de surmonter les obstacles de chaque étape du processus de développement de produits.
La gamme d’applications biomédicales couvre un vaste éventail de domaines thérapeutiques, ce qui entraîne une très large gamme d’exigences en matière d’essais. Divers agencements de montage doivent être ajoutés à un système d’essai universel afin de maintenir ou de manipuler correctement les éprouvettes et d’obtenir les résultats nécessaires. Dans de nombreux cas, les normes internationales telles que les normes ISO ou ASTM déterminent la conception finale de ces montages. Par ailleurs, beaucoup sont conçus sur mesure, spécifiquement selon les spécifications de l’appareil du client. Notre expérience au sein de l’industrie a contribué à la création d’un catalogue de mâchoires et de montages pour accueillir les appareils les plus courants et répondre aux normes les plus fréquemment utilisées. Notre groupe de solutions d’ingénierie est à votre disposition pour travailler avec vous afin de développer des montages spécifiques à vos besoins.


APPLICATION TENDANCE
ESSAIS DES DISPOSITIFS PORTABLES
Les tendances en matière de technologie portable suivent celles des industries biomédicales et électroniques au sens large : les appareils sont de plus en plus petits, intelligents et faciles à utiliser. Les dispositifs portables dans le domaine de la santé ont évolué vers des solutions qui réduisent le profil de l’appareil, offrent une plus grande intégration avec les applications pour smartphone et, surtout, permettent aux patients de recevoir leurs traitements à domicile plutôt que dans un cabinet médical. Alors que cette tendance se poursuit, les fabricants s’efforcent de développer des méthodes d’essai robustes pour évaluer mécaniquement tous les aspects de ces appareils et s’assurer qu’ils fonctionnent comme prévu. En plus de tester les composants des dispositifs d’injection, les fabricants sont également confrontés à des défis dans l’évaluation et la sélection des adhésifs pour ces produits.
L’industrie pharmaceutique s’appuie sur les essais mécaniques pour évaluer les systèmes d’administration de médicaments et leurs emballages associés. Les systèmes d’administration de médicaments peuvent utiliser des voies d’administration cutanée, sous-cutanée, intramusculaire, orale ou nasale et se présentent sous différents formats d’emballage. Les systèmes d’essai universels sont utilisés tout au long du processus de développement de produits pour aider à identifier les matériaux appropriés, évaluer les mécanismes d’administration, effectuer la validation de la conception, valider les processus de fabrication et permettre des mesures de contrôle qualité appropriées. Les applications les plus courantes sont liées aux systèmes d’injection à base d’aiguilles et impliquent soit des essais fonctionnels basés sur des normes industrielles telles que les normes ISO 11040 et ISO 11608, soit des essais d’utilisabilité des produits pour compléter les essais des facteurs humains.
Les consommables médicaux représentent la plus grande sous-section des essais biomédicaux et comprennent une grande variété de produits à usage unique tels que les outils chirurgicaux, les équipements de protection individuelle (EPI), les produits de fermeture des plaies, les produits de prélèvement d’échantillons, et bien plus encore. Ces produits sont généralement des dispositifs médicaux de classe I ou II de la FDA qui, bien qu’ayant des exigences d’essai moins strictes, sont produits en si grandes quantités qu’il faut prendre des précautions pour tenir compte des essais à volume élevé. Pour compenser les volumes plus importants, le débit et la répétabilité deviennent des exigences d’essai essentielles, qui sont satisfaites grâce à des montages spécialisés, des flux de travail efficaces pour les opérateurs et des logiciels intuitifs.
À des fins diagnostiques et thérapeutiques, le marché des dispositifs vasculaires interventionnels a connu une croissance exponentielle. Les produits tels que les fils guides et les cathéters sont essentiels pour la cartographie de la vascularisation, l’élimination des blocages et la pose d’endoprothèses ou d’implants. L’évaluation des propriétés des matériaux et des revêtements de ces produits est essentielle pour s’assurer qu’ils fonctionneront comme prévu in vivo. Les essais in vitro peuvent également être réalisés à l’aide de systèmes clés en main conçus pour imiter les conditions réelles avec des modèles anatomiques, en mesurant les forces liées au déploiement et au retrait de ces dispositifs. Les dispositifs implantés tels que les valves de remplacement et les endoprothèses sont également testés pour leur durabilité à long terme à l’aide de systèmes dynamiques afin de valider les réponses à long terme de ces produits aux conditions corporelles.
Les biomatériaux comprennent les matériaux présents dans la nature, le corps humain et d’autres espèces animales. Ces matériaux peuvent être des tissus durs tels que les os ou l’émail dentaire, ou des tissus mous tels que les tendons et les ligaments. La variation biologique et les facteurs environnementaux affectent les propriétés mécaniques de ces matériaux. Ils sont également anisotropes et non homogènes, ce qui en fait des matériaux difficiles à recréer ou à concevoir en dehors de la nature.
Les implants orthopédiques sont des implants qui soutiennent le système squelettique. Il s’agit notamment des vis, des plaques, des tiges et des broches pour la réparation des fractures osseuses, ainsi que des hanches, des genoux et des composants rachidiens artificiels entiers. Les implants orthopédiques peuvent être insérés temporairement dans le corps pour aider à la guérison d’un patient, ou peuvent être insérés dans le corps avec l’intention que l’implant survive au patient. Selon leur utilisation, les implants orthopédiques sont généralement considérés comme des dispositifs médicaux de classe II ou III par la FDA et nécessitent une gamme et une combinaison d’essais mécaniques statiques et de fatigue.
Les matériaux dentaires sont généralement composés de métal, d’élastomères et de polymères. Les dispositifs de restauration et de prosthodontie sont souvent composés de plusieurs matériaux qui nécessitent des essais mécaniques pour déterminer comment ces matériaux interagissent pour former le dispositif fini. Un implant dentaire est un pilier métallique, généralement en titane, qui remplace toute la dent du patient. Les essais de fatigue représentent la forme la plus courante d’essais mécaniques effectués sur les implants dentaires, conformément aux normes internationales, afin d’évaluer l’usure prévue en cas d’utilisation répétée.
INTÉGRITÉ ET VALIDATION DES DONNÉES
Le concept d’intégrité des données est fondamental pour la fabrication de produits biomédicaux et est le moteur des programmes de qualité qui garantissent la sécurité des produits. À l’échelle mondiale, il existe de nombreux cadres réglementaires qui visent à définir ce qu’est l’intégrité des données et comment elle doit être assurée, qu’elle soit dictée par la FDA, les BPF ou d’autres organismes nationaux ou internationaux.
Conformité réglementaire
Au sein de l’industrie biomédicale, il existe des organismes de réglementation nationaux et internationaux qui définissent les protocoles nécessaires pour garantir que la sécurité des patients est au centre du développement et de la fabrication des produits. Des organisations comme la FDA et le MDR de l’UE exigent des processus rigoureux de contrôle de la qualité et d’intégrité des données. Notre suite de logiciels et de services permet aux clients de mieux maintenir la conformité de leurs programmes d’essais mécaniques.
Services de validation IQOQ
Nos équipes de service après-vente fournissent des services de validation et de documentation pour prendre en charge les processus IQOQ conçus pour garantir que votre équipement de test Instron fonctionne aux fins prévues et produit des résultats valides conformément aux normes 21 CFR 820.72 et ISO 13845. À la fin de nos services, nous fournissons un certificat d’achèvement pour la qualification de l’installation et du fonctionnement qui sera signé par l’ingénieur de service après-vente d’Instron qui a effectué les validations.
Bluehill Central
Le logiciel Bluehill Central est un outil de gestion de laboratoire qui permet une gestion centralisée et à distance des applications logicielles Bluehill Universal associées à plusieurs bâtis d’essai Instron. Le logiciel vous permet de gérer à distance tous les utilisateurs de Bluehill Universal, les modèles d’essai, les résultats, les approbations de révision de fichiers et les données de piste d’audit de plusieurs systèmes Instron.
Traçabilité
Le module de traçabilité de Bluehill Universal permet aux utilisateurs de répondre aux exigences d’audit associées à la partie 11 du titre 21 du CFR de la FDA, ainsi qu’à celles des normes ISO 17025, Nadcap et d’autres organismes de réglementation. Grâce à l’intégration transparente des approbations électroniques, de l’historique des révisions et d’une piste d’audit automatisée, cet ajout puissant se combine à la sécurité intégrée de Bluehill pour offrir une traçabilité inégalée des données.
En savoir plus sur la traçabilité Bluehill
En savoir plus sur l’intégrité des données et la traçabilité Bluehill

L’automatisation représente une opportunité de croissance dans un éventail d’applications et tout au long du processus de développement de produits. Dans les laboratoires de contrôle qualité à petit et moyen volume, les difficultés liées à la rotation du personnel et aux difficultés d’embauche entraînent l’adoption de technologies d’automatisation telles que les cobots et les platines XY afin d’améliorer l’efficacité du laboratoire. Même au sein des laboratoires de R&D ou de vérification des dispositifs, l’automatisation peut garantir que les ingénieurs d’essai et les autres employés qualifiés sont en mesure de concentrer leur temps sur des activités à valeur ajoutée plutôt que sur des essais manuels. Au fur et à mesure que les entreprises passent à la production de dispositifs, la réalisation d’essais mécaniques complets en ligne est un levier essentiel pour améliorer le contrôle du processus de fabrication et réduire le gaspillage de matériaux ou les produits défectueux. Chaque ajout d’automatisation a le potentiel d’améliorer l’efficacité du laboratoire, de réduire la variabilité et de simplifier les procédures d’essai.
SYSTÈMES D'ESSAIS RECOMMANDÉS
Platine XY automatisée AT2 pour les systèmes d’essai universels
Le système XY automatisé peut effectuer des essais de compression, de flexion ou de traction sur plusieurs composants ou à plusieurs endroits sur un seul dispositif dans le cadre d’une seule configuration d’essai, ce qui améliore l’efficacité des essais.
Système d’essai ElectroPuls à 16 stations
Couramment utilisé pour les essais in vitro des composants d’endoprothèses vasculaires, le système d’essai ElectroPuls à 16 stations effectue des essais de fatigue à très grand nombre de cycles sur jusqu’à 16 échantillons simultanément, avec un capteur de force nominal de fatigue et un réglage de précision pour chacun.







 Essais ISO 7886-1 des seringues hypodermiques stériles
Essais ISO 7886-1 des seringues hypodermiques stériles ISO 11040 - Conception et propriétés fonctionnelles des seringues préremplies
ISO 11040 - Conception et propriétés fonctionnelles des seringues préremplies ISO 80369 - Connecteurs de petit diamètre pour liquides
ISO 80369 - Connecteurs de petit diamètre pour liquides Essais d’aiguilles de seringue
Essais d’aiguilles de seringue ISO 11608-1:2022 Systèmes d’injection à base d’aiguilles
ISO 11608-1:2022 Systèmes d’injection à base d’aiguilles Essais de force d’étanchéité résiduelle (RSF)
Essais de force d’étanchéité résiduelle (RSF) Performance à l’impact des comprimés pharmaceutiques
Performance à l’impact des comprimés pharmaceutiques ASTM D7860 Rétention du couple pour les emballages protège-enfants
ASTM D7860 Rétention du couple pour les emballages protège-enfants Essais des EPI - Y compris les masques, les gants et les écouvillons nasaux
Essais des EPI - Y compris les masques, les gants et les écouvillons nasaux ASTM F88 Résistance au scellage des matériaux de barrière souples
ASTM F88 Résistance au scellage des matériaux de barrière souples Essai à l'aiguille courbe selon la norme ASTM F3014
Essai à l'aiguille courbe selon la norme ASTM F3014 EN455-2, ISO 11193, ASTM D6319 Essais de traction des gants médicaux
EN455-2, ISO 11193, ASTM D6319 Essais de traction des gants médicaux Essais de traction des sutures chirurgicales
Essais de traction des sutures chirurgicales Essais d’endoprothèses
Essais d’endoprothèses Essais de fatigue des matériaux et des structures d’endoprothèses
Essais de fatigue des matériaux et des structures d’endoprothèses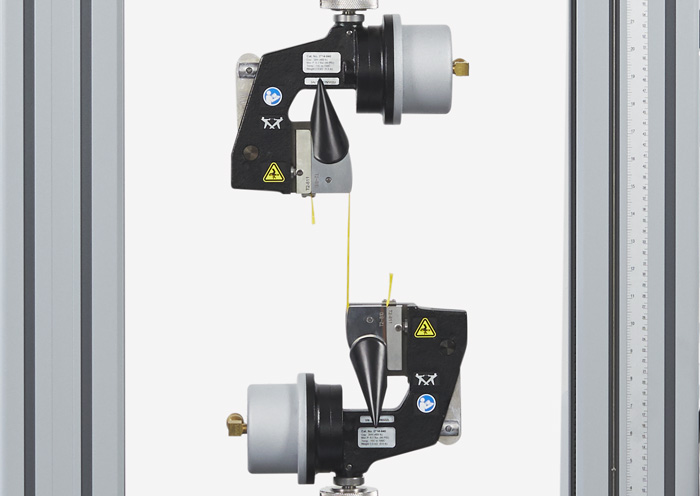 Essais de traction des tubes de cathéters ISO 10555
Essais de traction des tubes de cathéters ISO 10555 Essais de fils guides
Essais de fils guides ASTM F2458 Résistance à la fermeture des plaies des adhésifs et des mastics tissulaires
ASTM F2458 Résistance à la fermeture des plaies des adhésifs et des mastics tissulaires ASTM F2256 Propriétés de résistance des adhésifs tissulaires par essai de pelage en T
ASTM F2256 Propriétés de résistance des adhésifs tissulaires par essai de pelage en T Essais d’hydrogels polymères selon la norme ASTM F2150
Essais d’hydrogels polymères selon la norme ASTM F2150 Essais des tissus durs
Essais des tissus durs Essais des tissus mous
Essais des tissus mous ASTM F543 - Essais axiaux et de torsion des vis osseuses médicales métalliques
ASTM F543 - Essais axiaux et de torsion des vis osseuses médicales métalliques Essais de fatigue cyclique des constructions d’implants rachidiens conformément aux normes ASTM F1717-18, ASTM F2706-18 et ISO 12189-8
Essais de fatigue cyclique des constructions d’implants rachidiens conformément aux normes ASTM F1717-18, ASTM F2706-18 et ISO 12189-8 Essais de fatigue cyclique des prothèses d’implants de hanche artificiels conformément aux normes ISO 7206-4, ISO 7206-6, ISO-7206-8 et ASTM F2068
Essais de fatigue cyclique des prothèses d’implants de hanche artificiels conformément aux normes ISO 7206-4, ISO 7206-6, ISO-7206-8 et ASTM F2068 Essais des dispositifs de fixation des fractures
Essais des dispositifs de fixation des fractures ASTM F2077 Caractérisation et fatigue des dispositifs de fusion intervertébrale rachidienne
ASTM F2077 Caractérisation et fatigue des dispositifs de fusion intervertébrale rachidienne ASTM F2267 Évaluation des dispositifs de fusion intervertébrale rachidienne sous charge axiale
ASTM F2267 Évaluation des dispositifs de fusion intervertébrale rachidienne sous charge axiale Essais de fatigue cyclique des composants de plateau tibial conformément aux normes ASTM F1800 et ISO 14879
Essais de fatigue cyclique des composants de plateau tibial conformément aux normes ASTM F1800 et ISO 14879 ISO 16402 Essais de flexion des ciments de résine acrylique utilisés en orthopédie
ISO 16402 Essais de flexion des ciments de résine acrylique utilisés en orthopédie ISO 14801 Essais de fatigue des implants dentaires endo-osseux pré-anglés dans un bain de fluide
ISO 14801 Essais de fatigue des implants dentaires endo-osseux pré-anglés dans un bain de fluide Essais de broches : matériaux métalliques, plastiques, céramiques
Essais de broches : matériaux métalliques, plastiques, céramiques









